Tìm hiểu Bảng Tính Tan Hóa HọcLớp 8+9+11 Đầy Đủ & Chi Tiết là chủ đề trong nội dung bây giờ của chúng mình. Theo dõi nội dung để tham khảo nhé.
Bảng tính tan thể hiện tính tan hay không tan của một chất (muối, bazo hoặc axit) trong nước. Nó cho biết độ tan các chất trong nước: chất nào kết tủa, bay hơi, chất tan hay không tan giúp cho các em giải các bài toán hóa học. Hãy cùng chúng tôi tìm hiểu nhé
Bảng tính tan đầy đủ nhất
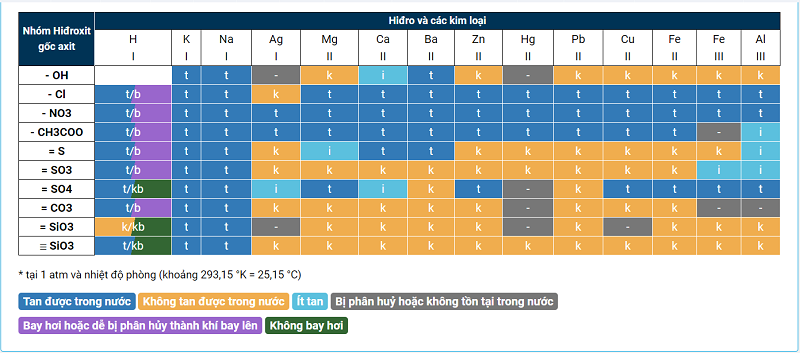
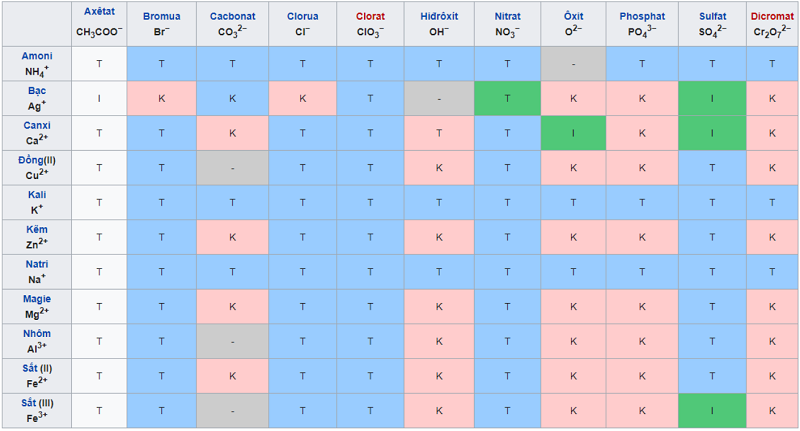
Cách học bảng tính tan nhanh nhất
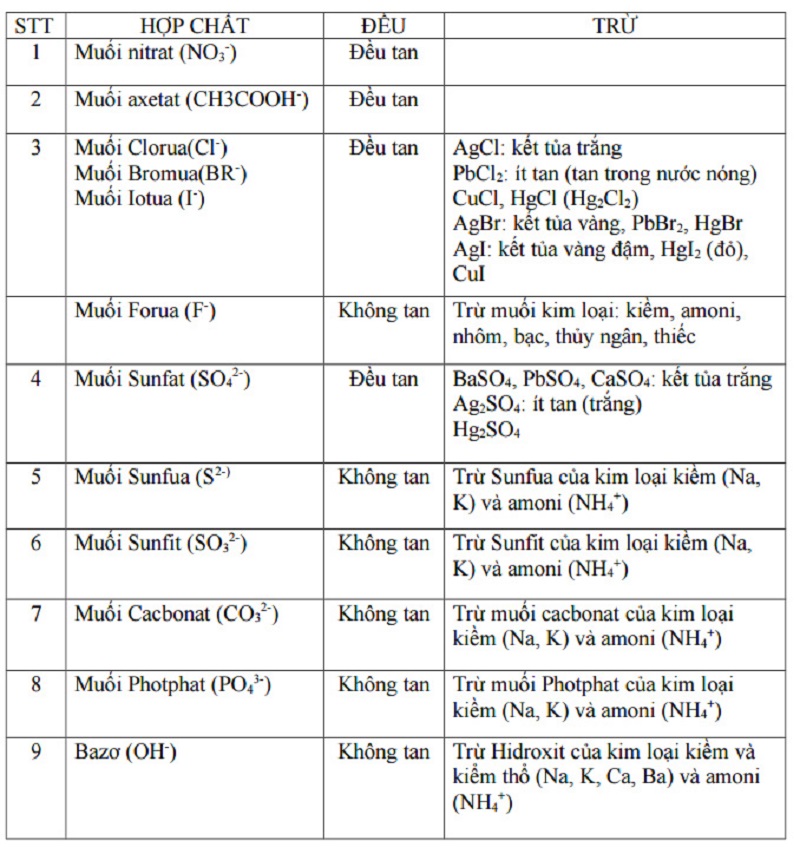
| Hợp chất | Tính chất | Trừ |
| Axit (xem ở cột ion H+ và anion gốc axit tương ứng). | Đều tan. | H2SiO3 |
| Bazo (xem ở hàng ion OH– và các cation tương ứng). | Không tan. | LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, NH4OH. |
| Muối liti Li+
Muối natri Na+ Muối kali K+ Muối amoni NH4+ |
Đều tan. | |
| Muối bạc Ag+ | Không tan (thường gặp AgCl). | AgNO3, CH3COOAg. |
| Muối nitrat NO3–
Muối axetat CH3COO– |
Đều tan. | |
| Muối clorua Cl–
Muối bromua Br– Muối iotua I– |
Đều tan. | AgCl: kết tủa trắng
AgBr: kết tủa vàng nhạt AgI: kết tủa vàng PbCl2, PbBr2, PbI2. |
| Muối sunfat SO42- | Đều tan | BaSO4, CaSO4, PbSO4: trắng
Ag2SO4: ít tan |
| Muối sunfit SO32-
Muối cacbonnat CO32- |
Không tan | Trừ muối với kim loại kiềm và NH4+ |
| Muối sunfua S2- | Không tan | Trừ muối với kim loại kiềm, kiềm thổ và NH4+ |
| Muối photphat PO43- | Không tan | Trừ muối với Na+, K+ và NH4+ |
Màu một số bazơ không tan hay gặp
| Bazo | Màu sắc |
| Mg(OH)2 | Trắng |
| Cu(OH)2 | Xanh lam |
| Al(OH)3 | Keo trắng |
| Zn(OH)2 | Trắng |
| Pb(OH)2 | Trắng |
| Cr(OH)3 | Lục xám |
| Mn(OH)2 | Hồng nhạt |
| Fe(OH)2 | Trắng xanh |
| Fe(OH)3 | Nâu đỏ |
Học bảng tính tan bằng thơ
Bazơ, những chú không tan:
Đồng, nhôm, crôm, kẽm, mangan, sắt, chì
Ít tan là của canxi
Magie cũng chẳng điện li dễ dàng.
Muối kim loại kiềm đều tan
Cũng như nitrat và “nàng” hữu cơ
Muốn nhớ thì phải làm thơ!
Ta làm thí nghiệm bây giờ thử coi,
Kim koại I (IA), ta biết rồi,
Những kim loại khác ta “moi” ra tìm
Photphat vào nước đứng im (trừ kim loại IA)
Sunfat một số “im lìm trơ trơ”:
Bari, chì với S-r
Ít tan gồm bạc, “chàng khờ” canxi,
Còn muối clorua thì
Bạc đành kết tủa, anh chì cố tan (giống Br- và I-)
Muối khác thì nhớ dễ dàng:
Gốc SO3 chẳng tan chút nào! (trừ kim loại IA)
Thế gốc S thì sao? (giống muối CO32-)
Nhôm không tồn tại, chú nào cũng tan
Trừ đồng, thiếc, bạc, mangan, thuỷ ngân, kẽm, sắt không tan cùng chì
Đến đây thì đã đủ thi,
Thôi thì chúc bạn trường gì cũng vô!
Lý thuyết tính tan
Nếu bạn chưa nắm rõ lý thuyết thì phần này dành cho bạn
Chất tan & Chất không tan
Ở trong môi trường nước ( H20 ), có những chất tan và có những chất không tan, cũng có chất tan ít, chất tan nhiều
Đặc tính tan của Axit, Bazơ và muối
- Axit : Phần lớn các chất axit tan được trong môi trường nước trừ axit Silixic
- Bazo : Hầu hết các bazo không thể tan trong nước trừ một số hợp chất như : KOH, NaOH…
- Muối :
Muỗi natri, kali đều tan.
Những muối nitrat đều tan.
Hầu hết các muối clorua, sunfat đều tan được. Nhưng hầu hết các muốn Cabonat đều không tan
Độ tan của một số chất trong môi trường nước
Định nghĩa độ tan: Độ tan ( được ký hiệu là S ) của một chất trong môi trường nước là số gam chất đó hòa tan được trong 100 gam nước để tạo ra dung dịch bão hòa ở nhiệt độ xác định
Các yếu tố gây ảnh hưởng đến độ tan
- Độ tan của một chất rắn ở trong nước phụ thuộc và nhiệt độ, trong một số trường hợp nhiệt độ tăng thì độ tan tăng theo. Một số ít thì ngược lại, nhiệt độ tăng thì độ tan giảm
- Độ tan của một chất khí phụ thuộc vào nhiệt độ, áp suất. Độ tan sẽ tăng nếu ta tăng ấp suất và giảm nhiệt độ.
Trên đây là bảng tính tan giúp các bạn dễ dàng tra cứu hoặc học thuộc. Chúc bạn thành công trong học tập